天然蜘蛛丝因其出色的机械性能在生物医学、高端运动器材和军事装备等领域具有巨大的应用潜力。然而,由于天然蜘蛛具有强烈的领地意识和存在同类相食的特性,因此无法像家蚕那样进行养殖以获得大量的蛛丝纤维。此外,天然蜘蛛丝的组成和结构复杂,这使得人工合成的蛛丝蛋白纤维在韧性和稳定性方面尚未达到与天然蜘蛛丝相媲美的水平。因此,开发具有优异韧性和批次差异稳定的人工蛛丝蛋白纤维仍然面临挑战。
近日,河北工业大学化工学院李焕荣课题组与清华大学,中国科学院长春应化所合作,在制备高韧性和批次间稳定的工程蛋白纤维的研究中取得新进展。该研究开发的超强韧人工蛛丝纤维,包含了源自天然蜘蛛蛋白的牵引丝序列和一种带正电荷的类弹性蛋白序列。通过这两种人工蛛丝蛋白的β-sheet结构共同组装,实现了人工纤维性能的高度稳定性。此外,双组分人工蛛丝蛋白纤维还具有在植入式甚至可食用设备中潜在应用的优势。
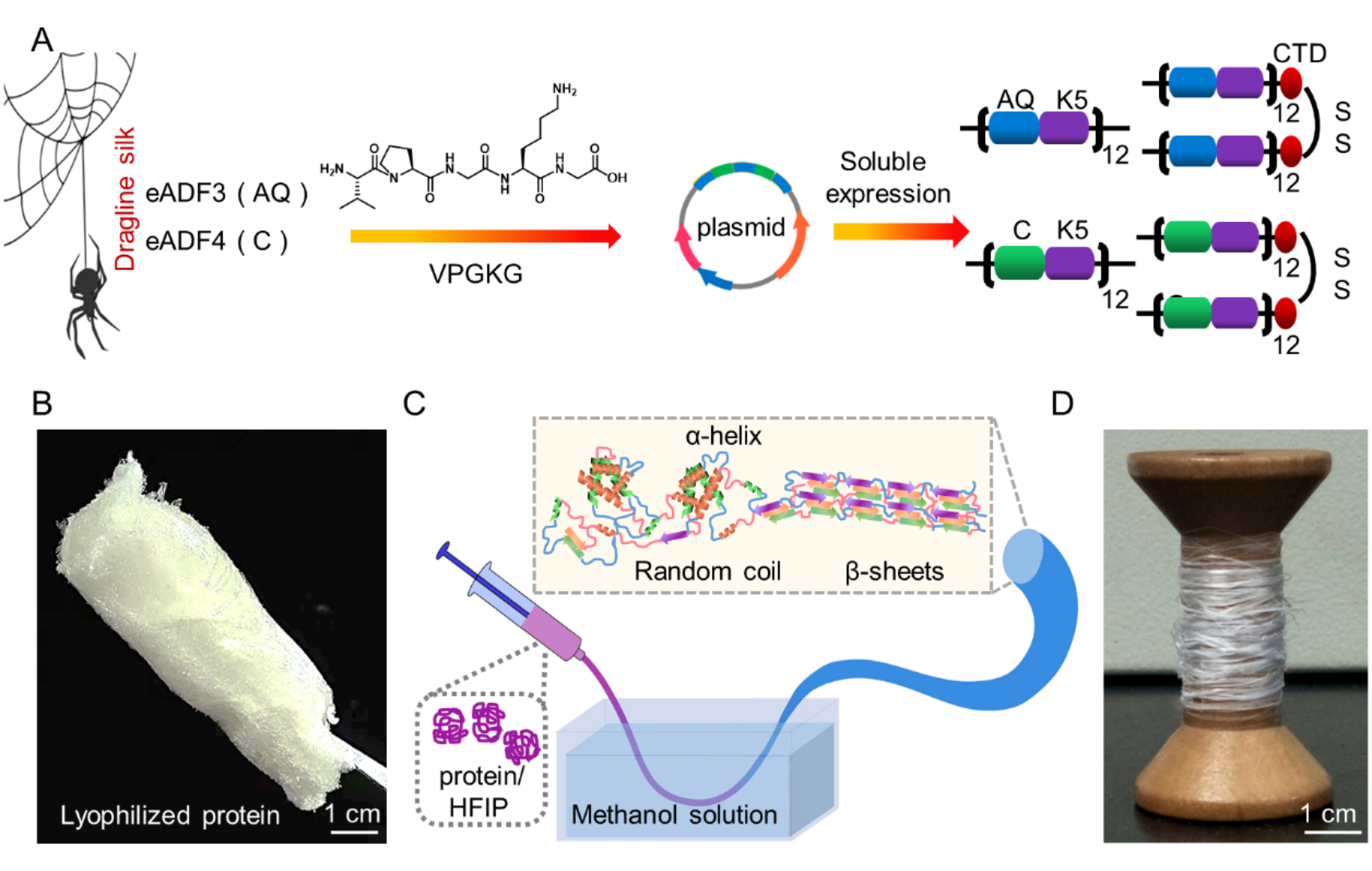
首先,通过融合表达的方式,获得了四种模块化人工蛛丝蛋白。在模块化蛋白体系中,蛛丝蛋白的poly(A)基序可以形成β-sheet微晶结构为纤维强度提供保障,GPGQQ基序可形成螺旋结构赋予纤维良好延展性和韧性;具有柔性结构的类弹性蛋白基序为纤维提供韧性支持,同时类弹性蛋白模块的亲水性促进了模块化重组蛛丝蛋白可溶性表达。此外,引入天然蛛丝蛋白的羧基末端结构域(CTD),有助于蛋白分子间形成交联网络,同时促进β-sheet结构的形成,从而提升纤维力学性能。这些人工蛛丝蛋白纤维的韧性可达200 MJ/m3,高于目前已报道的重组蜘蛛蛋白基纤维。
此外,作者进一步将两种人工蛛丝蛋白混合后制备了双组分蛋白纤维。与单组分蛋白纤维相比,两种人工蛛丝蛋白之间的相互作用促进了β-sheet结构的分子间组装,增加了刚性结构的含量。同时,两种蛋白相互作用导致纤维内部β-sheet结构的构象转变,增强了分子间作用力。这些都有利于提高双组分人工蛛丝蛋白纤维的机械强度和批次间的稳定性。另外,引入共价亚胺交联网络进一步提高了纤维的强度,其断裂强度达到400 MPa,成功实现了使用分子量相对较小的人工蛛丝蛋白,通过简单的纺丝工艺制备高质量纤维的目标。
与此同时,双组分人工蛛丝蛋白纤维中含有18种不同类型的氨基酸,其中包括6种人体必需氨基酸(异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苏氨酸和缬氨酸)。因此,对双组分蛋白纤维的食用性和生物安全性进行了评估。研究结果表明,双组分人工蛛丝蛋白纤维具有良好的生物安全性和可食用性,为其在生物医学和医疗器械领域的潜在应用铺平了道路。
相关研究成果以“Spidroin-mimetic Engineered Protein Fibers with High Toughness and Minimized Batch-to-batch Variations through β-sheets Co-assembly”为题发表在Angew. Chem. Int. Ed.上(Angew. Chem. Int. Ed., 2024, e202400595.)。论文的第一作者为河北工业大学秦达文博士,论文通讯作者为河北工业大学李焕荣教授,清华大学刘凯教授和中国科学院长春应化所李敬敬副研究员。此研究工作得到了国家重点研发计划(2022YFA0913200、2021YFB3502300、2021YFF1200300)、国家自然科学基金(22125701、22388101、22020102003、22377121、22107097、52222214、52372274、22361132542、22277064)、CAS青年创新促进会(2021226200228)、吉林省自然科学基金项目(20210101366JC)的支持。
论文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202400595